新しい治療法の効果やリスクが検証される際、副作用よりも大きな枠組みで「有害事象」というものがあります。
当研究会では、移植後に患者さんに起こった健康状態の悪化を、移植との因果関係の考察と共に、すべての移植後、また移植後観察期間終了後に提出いただいています。(下記評価項目、因果関係参照)
必要に応じて、使用したドナー便の状態確認や再検査を行う場合もあります。
当研究会で実施した移植の有害事象
有害事象評価項目(アメリカ国立衛生研究所に準拠)
- なし
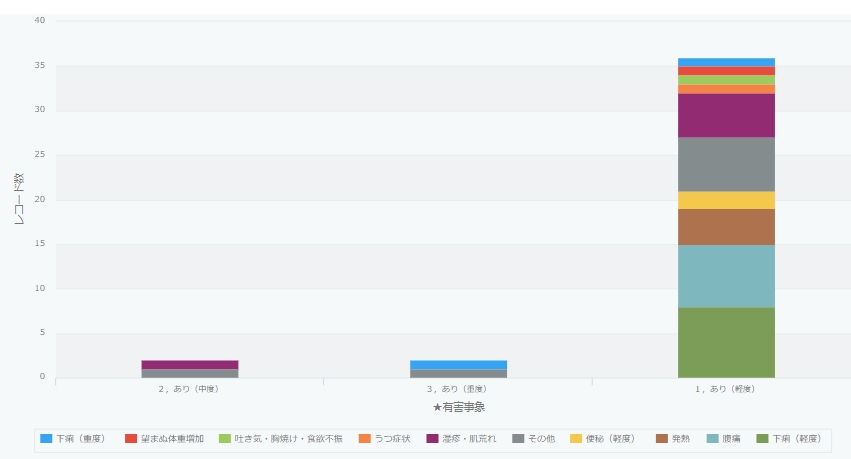
- あり(軽度)36件:日常生活に支障なし
- あり(中度) 6件:日常生活に支障あり
- あり(重度) 2件:緊急手術または入院が必要。永続的で重篤な障害が残る場合を含む
有害事象は、移植後の経過観察終了後に反映しております。(2022年12月6日更新)
移植との因果関係(アメリカ国立衛生研究所に準拠)
- 因果関係なし:他に原因がある、時期の不一致、生物学的にありえない
- 因果関係が考えにくい:他に原因がある、時期の不一致
- 因果関係がある可能性あり:他の要因と区別できない
- おそらく因果関係あり:妥当な時間的関係があり、他の要因がない場合
- 明らかに因果関係あり:明確なエビデンスが示され、他の要因が完全に否定できる
国内外の情報
FMTによる重大な有害事象は、独立行政法人医薬品医療機器総合機構からの「マイクロバイオーム研究に基づいた細菌製剤に関する報告書」に取り上げられています。以下は、それに基づいて記載しました。
国内では、重大な有害事象は報告されていないが、米国では2019 年に2 名(1 名死亡・1名回復)の重大な有害事象が報告されています。
2019 年3 月にマサチューセッツ総合病院(MGH)で、院内において作製された同一ドナー由来のFMT 経口カプセルを投与された2 名の患者がESBL(Extended spectrum β-lactamases)産生菌に感染しました。1 名はC 型肝炎による肝性脳症治療の目的でFMT が実施されたが、ESBL 産生菌感染が発覚、抗菌薬治療により回復しました。もう1名は骨髄異形成症候群の治療のため造血幹細胞移植を受ける患者(シクロホスファミドとミコフェノール酸モフェチル投与後)において、移植片対宿主病(graft-versus-host disease;GVHD)の予防の目的でFMT が実施されましたが、造血幹細胞移植後にESBL 産生菌感染が発覚し重度の敗血症により死亡しました。FDA は速やかにアラートを発し、全国でFMT の提供を停止させました。
原因究明が行われた結果、MGH ではFDA ガイドラインで求められているESBL 検査を行っておらず、ドナー便がESBL 産生菌に汚染されていたことが判明したため、アラート後3 ヶ月でESBL 検査を徹底する勧告を出してFMT を用いたIND 試験が再開されています。
さらに、2020 年には、6 名(全員回復)の重大な有害事象が報告されています。FDAは、本事象を、ドナー便に基因する腸管病原性大腸菌と志賀毒素産生性大腸菌による有害事象として、アラートを発しています。
このように、FMT の安全性に関して最も配慮すべき点は、重篤な感染症をもたらす可能性があることです。例えばCOVID-19 は、便中からウイルスが検出されたことから、感染の原因になりうることがパンデミックの早い段階で指摘されていました。FDA は2020 年3 月に安全性アラートを発し、2019 年12 月1 日以降に取得した便を用いたFMT 便ジュースの提供に際し、COVID-19 の感染防止対策(ドナーの感染検査とレシピエントの追加合意取得)を要請しました。
FDAがFMT に関するレビューの中で提案している配慮すべき感染症の検査として、病原性細菌、真菌、ウイルス、寄生虫などの検査がありますが、わが国ではE型肝炎ウイルスなども考慮する必要があるとされています。
(2022年9月20更新)





