<特定臨床研究>開始
・
自閉スペクトラム症に対する
新規糞便微生物移植法の有効性と安全性に関する特定臨床研究
当研究会に所属する医師等による臨床研究が開始されました。
jRCT(臨床研究等提出・公開システム)において公開されています。
https://jrct.mhlw.go.jp/latest-detail/jRCTs031230041
特定臨床研究に関する小冊子は以下のページよりご覧いただけます。

概要(jRCT公開情報に基づいて記載)
1.臨床研究の目的及び内容
研究の目的
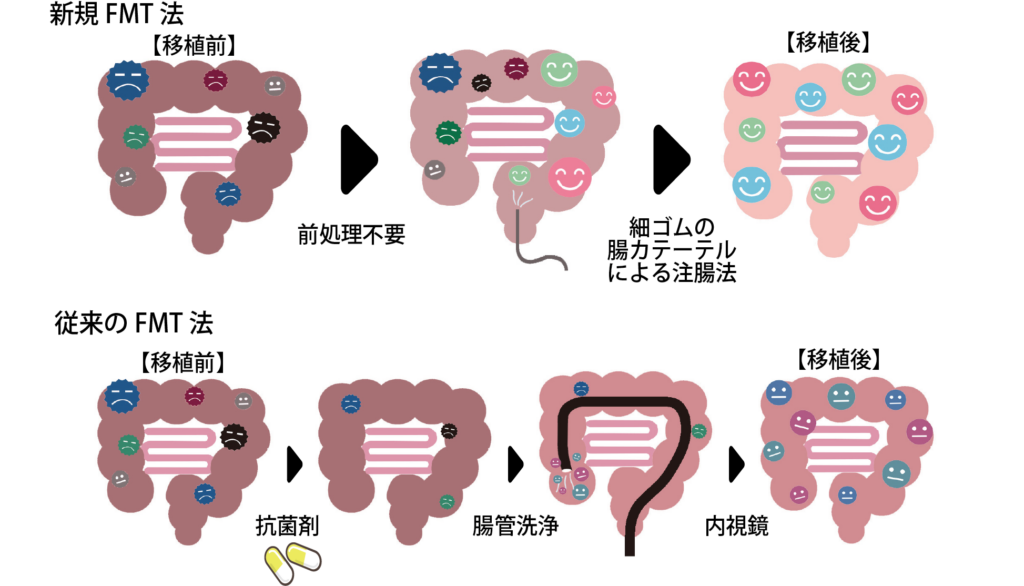
本臨床研究の目的は、自閉スペクトラム症(ASD)に対する「水素ナノバブル水により調製した糞便微生物溶液(SHIN-1)を用いる新規糞便微生物移植(FMT)法」の有効性と安全性を明らかにすることである。
本FMT法は、先行研究で行われている「FMT施行前の抗菌薬の投与や腸管洗浄」を必要とせず、また「それらの研究で用いられている投与量(細菌数)の約1000分の1」の少量の投与をもって実施する新しい方法として開発しているものである。
【新規FMT法と従来のFMT法との違い(概念図)】
試験のフェーズ
1.研究開発の初期段階における臨床研究
研究予定期間
2023年4月18日~2025年3月31日
計画研究対象者数
30名
試験デザイン
多施設共同、非無作為・非盲検、単群・前後比較試験
対象疾患名
自閉スペクトラム症
選択基準
1. 小児神経専門医、精神神経学会認定専門医、児童青年精神医学会認定医、或いは小児精神神経学会認定医のいずれかの専門医・認定医により、ASDの診断をされた5歳から12歳までの小児(要診断証明書、性別は不問)(注1)。
日本小児神経学会が認定する小児経専門医の名簿:
https://www.childneuro.jp/modules/senmoni/
2. 胃腸の症状を除けば一般的に良好な身体的健康状態である者(研究責任医師(注2)の判断)。
3. 本研究への参加について、文書、あるいは必要に応じてイラストや口頭で説明することにより同意が得られる者。
4.本研究への参加について、文書による同意が代諾者から得られる者。
除外基準
1. 医薬品による治療を施行中である者。
2. 過去3か月以内に抗生物質(局所抗生物質は除く)の投与 を受けた者。
3. 過去12ヶ月以内に糞便微生物移植を受けたことがある者。
4. ASD様症状を示す単一遺伝子障害(脆弱X症候群、レット 症候群、Joubert(ジュベール)症候群など、効果判定に影響を及ぼす可能性がある疾患)である者。
5. 脳神経外科・脳神経内科における疾患を有する者。
6. 経管栄養を行っている者。
7. 標準体重の65%未満の体重不足/栄養不足である者。
8. 一年以内に手術をしたか、あるいは半年以内に手術を予定している者。
9. 現在、他の臨床試験に参加中である者。
10. その他の理由で、研究責任医師が研究対象者として不適当と判断した者。

プロトコル治療
1. SHIN-1含有注腸液の投与スケジュール
SHIN-1含有注腸液を1週間に1回、連続6週間、計6回、注腸投与を行う。投与開始後、30週目の結果をもって、有効性の最終評価を行う。
2. 各週に投与する SHIN-1含有注腸液の内容
第1週目から6週目までの各週において投与する注腸液の内容は、下記の通りである。第1週から第6週までの各週の投与に用いるSHIN-1原液量を、それぞれ順に、3g、5g、7g、9g、11g、13gと設定し、それぞれに生理食塩水100gを加えて調整した6種の注腸液を用いて、投与を行う。
幼児であることを考慮して細いゴム状の注腸用チューブ(直径6.5mm)を注腸投与用として選択・使用
中止基準
<研究対象者に対する研究の中止>
研究責任医師は、研究対象者を登録後、研究対象者が以下の事項に該当することが判明した場合、当該研究対象者に対する研究を中止する。
1. 有害事象が発現し、本研究の継続により研究対象者の健康に容認できないリスクが生じると研究責任医師が判断した場合。
2. 研究対象者から研究中止の申し出があった場合。
3. 併用薬・併用療法を使用した場合、但し、効果安全性評価委員会が本研究の結果に影響を与えないと判断する場合は中止しない。
4. 研究対象者として不適切であることが判明した場合。
5. 研究対象者の都合で必要な観察、検査の実施が不可能であることが判明した場合。
6. その他、研究責任医師が介入を中止すべきであると判断した場合。
<臨床研究全体の中止>
研究代表医師は、下記に該当する場合、必要に応じて研究を中止又は中断する。
1. 予想される有害事象(疾病等)又は不具合等が計画時の想定を著しく超える場合等、研究対象者の安全性又は本研究の実施に悪影響を及ぼす可能性のある新たな重大な情報を入手した場合。
2. 研究対象者の登録が計画と比較して著しく遅い場合等、目標とする研究対象者数を達成することが極めて困難であると判断される場合。
3. 認定臨床研究審査委員会から本研究を中止すべき旨の意見を受けた場合。
4. その他、本研究の中止又は中断を必要とする状況が発生した場合。
主要評価項目
1. SRS-2
1) ASD重症度の変化量、及び中核症状の重症度の変化量を解析する。
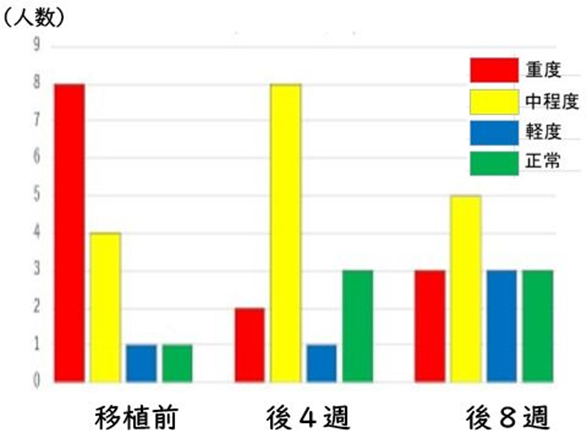
SHIN-1を用いる新規FMT法」によって、移植後8週において、14症例のうち、重度の6症例を含めた10症例(71%)に顕著なASD症状の軽減が認められた。
副次評価項目
1 . Gazefinder(注3)
1) 特定のエリアへの注視率によって、FMT施行前後におけるASD重症度の変化量を解析する。
2. PHQ-4
1)「うつ病と不安の4項目の尺度」から成る。
3. GSRS(胃腸症状評価尺度)
1) 消化管症状を評価する 15 項目からなるアンケートである。
4. BSスコア(Bristol Stool Form Scale, 便の状態変化の記録)
1) 大便の形状、色、及び硬さによって、7段階に分類する指標である。
5. 有害事象の発現件数、発現頻度有害事象は観察された時点を評価の対象とする。
(注1)研究対象者(ASD児)の年齢を5歳から2歳と設定した理由
ASDの人たちに対する支援の開始時期は、可及的早期とする考え方が世界の小児科医・精神科医の間ではコンセンサスとなっている(Zwaigenbaum L et al Pediatrics 136、2015,Suppl 1, S10-40. 等々)。一方、子どもを研究対象者とする場合、子どもの人権を尊重した、十分な倫理的配慮が必要であり、そのためにはインフォームド・アセントの取得が可能な対象者を選択する必要がある。ASDの4歳児・5歳児のコミュニケーション機能(理解・表出)に関する調査研究(Bal et al. Autism. Res, 2018.等々)において、コミュニケーション機能が5歳までに大幅に向上し、5歳児になれば「注意を向けるべき対象を合目的的・随意的に選択できる」などが示されている。これらのことから、5歳児であればアセントの意思伝達が可能であると考えられ、5歳を年齢の下限として設定した。また、年齢が高くなるにつれて、ASDの特性によって社会との軋轢が生じ、これによって本人が受ける過剰なストレスやトラウマが引き金となって、不安、うつなど様々な二次障害が生じ、治療が困難になっていく。小学校では特別支援学校もあり、二次障害の発生が少ない環境が作られている。このようなことから、年齢の上限を12歳とした。この選択基準は、倫理的配慮を考慮し、さらに二次障害の発生が少ない年齢として設定した。
なお、米国及び中国で行われた「FMTによるASD児の治療」に関する先行研究、また、米国及び中国において、現在進行中(或いは登録中)の「臨床研究から一歩進んだ治験」においては、下表のとおり、研究対象者の年齢は、それぞれ2歳及び3歳まで引き下げられている。
表 先行研究及び現在進行中(或いは登録中)の治験における研究対象者の年齢層
| 実施機関 | ステージ | 研究対象者の年齢層 |
| アリゾナ大 | 先行臨床研究 | 7歳-17歳 |
| 第三軍医大 | 先行臨床研究 | 3歳-17歳 |
| ProgenaBiome | 治験 | 2歳以上 |
| Ventura C.Trials | 治験 | 2歳以上 |
| LA小児病院 | 治験 | 5歳-17歳 |
| アリゾナ大 | 治験 | 5歳-17歳 |
| 武漢大学 | 治験 | 3歳-18歳 |
(注2)研究責任医師(6施設)の選定
自由診療の下で、ASD児に対して「糞便微生物溶液(SHIN-1)を用いる新規糞便微生物移植(FMT)」を施行した経験(少なくとも3症例)のある医師を選定した。
| 医療法人仁善会 田中クリニック | 大阪府生野区生野西2-3-8 電気館ビル1階 06-6711-3770 | 田中 善 | 理事長 | https://www.tanaka-cl.com/fmt.html |
| ルークス芦屋クリニック (現:城谷バイオウェルネスクリニック内科・矯正歯科 神戸三宮) | 兵庫県芦屋市大原町8‐2 0797-23-6033 | 城谷 昌彦 | 院長 | https://www.lukesashiya.com/feature/flora.html |
| 医療法人喜和会 喜多村クリニック | 福岡県大野城市錦町4-3-8 092-581-6640 | 喜多村 邦弘 | 院長 | http://www.kitamura.or.jp/contents_fmt.html |
| 医療法人悠亜会 かわい内科クリニック | 大阪市城東区東中浜3-7-14 06-6962-3133 | 川井 勇一 | 理事長 | https://www.kawai-medical.com/diagnosis02/ |
| 医療法人ふたまた会 ナチュラルアートクリニック | 東京都千代田区六番町6‐5 アンドロイドビル2F 03-6256-8448 | 御川 安仁 | 院長 | https://naturalartclinic.com/alternative-therapy/1549 |
| 医療法人 はるなクリニック | 大阪府大阪市淀川区西三国 1丁目3‐13‐202 06-4807-5130 | 春名 令子 | 副院長 | https://www.haruna-clinic.com/541-2 |
(注3) Gazefinder
本装置は、この機器は、2分程度の動画を見て、どこを見ていたかなど、ものの見方からASDの特性を客観的に評価する一つのツールです。画面を見るだけで検査ができますので、お子さんにとって負担が少ない検査である。本装置は、客観性と定量性を併せ持つ世界で初めての自閉スペクトラム症診断補助装置として注目されている。本技術は、本臨床研究に参加する、浜松医科大学・土屋賢治教授、及び大阪大学医学部・片山泰一教授らが関発したものである。現在、JVCケンウッド社がオーストラリア及び日本で承認申請中である。

(画像提供:株式会社JVCケンウッド)
2.研究の概略図(シェーマ)
非盲検・前後比較試験
<前後比較試験を選択した理由>
1) 本臨床研究は開発初期の探索的な臨床研究であり、また研究対象者が幼児であることから倫理面を考慮に入れて、対照群を設けず、単群・前後比較試験をもって実施することにした。
2)「前後比較試験において、本臨床研究における有効性を示すことができる」とする理由は、本研究期間中に、ASD児がたとえ療育を続けていたとしても、「本試験の結果には影響を及ぼさない」からである。その理由は以下の通りである。
国立成育医療研究センター・立花らは、国内外のASD療育プログラムの効果に関するランダム化比較対照試験のメタ解析を行った結果、療育によって、ASDの重症度・発達指数・受容性言語・表出性言語などのアウトカムに差は認められなかったことを報告している。
3) FMTのASDに対する有効性に関する米国アリゾナ大学及び中国・第三軍医大学の先行研究においても前後比較試験で実施されている。
3.探索的評価項目:16S rRNA遺伝子解析によるASD児・腸内細菌叢構成の解析
16S rRNA遺伝子解析によるASD児の腸内細菌叢構成の解析を下記の時期に行うものとする。
<解析時期>
・ FMT施行前 ・FMT施行後8週目 ・ FMT施行後30週目
これまでの検討から、ASD児の腸内細菌叢の構成には、定型発達児とは異なる5つの特徴があることを見出している。
本臨床研究においては、5つの特徴のASDに対する診断能に関して検討を行う。
4.「同一の蓄積便から調製したSHIN-1」の使用とロット管理
これまで、シンバイオシス社は、当医療機関と共同で、FMTによる ASDの治療における原材料・中間体のロット管理を既に行ってきた。しかし、この場合は、いずれも、研究対象者(ASD児)毎に、異なったドナー便を用いていた。
本臨床研究においては、健康状態が万全な一名のドナーからの便を蓄積・保管した便から調製したSHIN-1を30名のASD児に投与することとする。即ち、本臨床研究では、全てのASD児に、同一の糞便微生物叢を有するSHIN-1を投与することになる。
ロット管理は従来と同様に行う。
即ち、1名の健常人ドナーからの蓄積便及びSHIN-1にロット番号を付し、これに、健常人ドナーの各種検査及び診察の結果、またドナー便の感染症を含めた便検査及び16S rRNA遺伝子解析、さらには(匿名化した)研究対象者の移植前後の各種検査結果(主要評価項目、副次評価項目、及び糞便の16S rRNA遺伝子解析の結果)を紐付けて、20年間は保存するものとする。
また、検査で用いた糞便の一部に加えて、ドナーの検査で用いた血清、血漿、全血、及び尿を-80℃で少なくとも20年間は保存するものとする。
5.観察・検査・評価のスケジュール
研究責任医師は、「観察・検査スケジュール」に従って、データを収集する。研究対象者の検査・観察・評価は原則として同一の研究責任医師が実施する。
スタディーカレンダー
-883x1024.jpg)
問い合わせ先:臨床研究事務局
E-mail:rinshokenkyu.jimukyoku@gmail.com
TEL:06-6356-2220 FAX:06-6777-2204 (平日10時~18時)
研究協力者募集のお問い合わせフォームはこちらからhttps://fmt.sym-biosis.co.jp/news/notice/9282/(募集は終了しています)
・
その他の お知らせ・活動報告 に関する記事
Articles about other お知らせ・活動報告

2026年03月03日
自閉スペクトラム症(ASD)特定臨床研究・国際論文発表会(大阪・東京)開催のご案内
この度、当研究会が2021年より推進してまいりました「自閉スペクトラム症(ASD)に対する特定臨床研究」の成果が、国際学術誌『Frontiers in Pediatrics』に受理されました。これを記念し、本研究の成果を […]

2026年03月03日
【論文受理】自閉スペクトラム症(ASD)に対するNanoGAS®-FMTの特定臨床研究成果論文が国際学術誌に受理
この度、当研究会が推進してまいりました、自閉スペクトラム症(ASD)児を対象とした次世代FMT(NanoGAS®-FMT)法の有用性と安全性に関する特定臨床研究の結果が、2026年2月2日に国際学術誌『Frontiers […]

2026年02月03日
第38回 日本口腔機能水学会 学術大会に出展いたします
当研究会は、2026年2月28日(土)、3月1日(日)に開催される「第38回日本口腔機能水学会学術大会」にブース出展いたします。 今回の大会テーマは「DX時代の歯科医療における口腔機能水の役割 ― シンプルだからこそ強い […]




