FMTのゴールは? 移植回数と事前抗生剤投与が菌の生着に与える影響

移植回数と事前抗生剤投与が菌の生着に与える影響
執筆者:Taylor S. Cohen Vancheswaran Gopalakrishn
所属:Microbiome Discovery, Microbial Sciences, BioPharmaceuticals R & D, AstraZeneca, Gaithersburg, MD 20878, USA
米国アストラゼネカ社生物製剤研究・開発部による情報
論文概要
SPFマウスを用い、FMTの定着試験を行った。
※SPFマウス…マウス固有の病原体を保有していないマウス
抗生剤の事前投与は3日間と3週間の2種類、その後1回あるいは5回のヒト由来のFMTを実施し、長期的に便を16S rRNAシークエンス(いわゆる次世代シーケンサー)で追跡した。
多様性の回復は3日間抗生剤投与群が早かった一方、ドナーの腸内細菌叢に似通った結果になったのは、3週間抗生剤投与後に5回のFMTを行った群だった。
背景と目的
腸内細菌が宿主の免疫システムなどに重要な役割を果たしているのはご存知のとおりで、そのバランスに乱れが生じることでいろんな病気が引き起こされていることも多々報告されています。
そんな中、腸内フローラバランスが乱れた状態(dysbiosis)を回復するため、FMT(便移植、腸内フローラ移植)という方法が試されており、Clostridium Difficile感染症、がん、潰瘍性大腸炎に至るまで幅広い疾患において臨床試験が行われています。
ヒトの臨床試験に先立って当然動物実験が行われていますが、無菌マウスでFMTの試験を行うには、いろいろと障壁があるとのこと。
例えば、無菌マウスは、B 細胞、T 細胞、IgA などの免疫機構の働きが正常ではなく、腸の粘液層も未熟で、疾患への影響をうまく観察できないことがあり、この実験では SPFす。マウスという、菌はいるがマウス固有の病原体を保有していないマウスを用いています。
さらに、未だ確立されていない「FMTによる菌の定着」という側面から、抗生剤の事前投与やFMTの回数によっていろいろ試してみようというのがこの実験の主旨です。
方法
生まれて6週間のマウスたちは、下記の6グループに分けられました。それぞれに割り当てられたマウスは5匹ずつ、全部で30匹です。
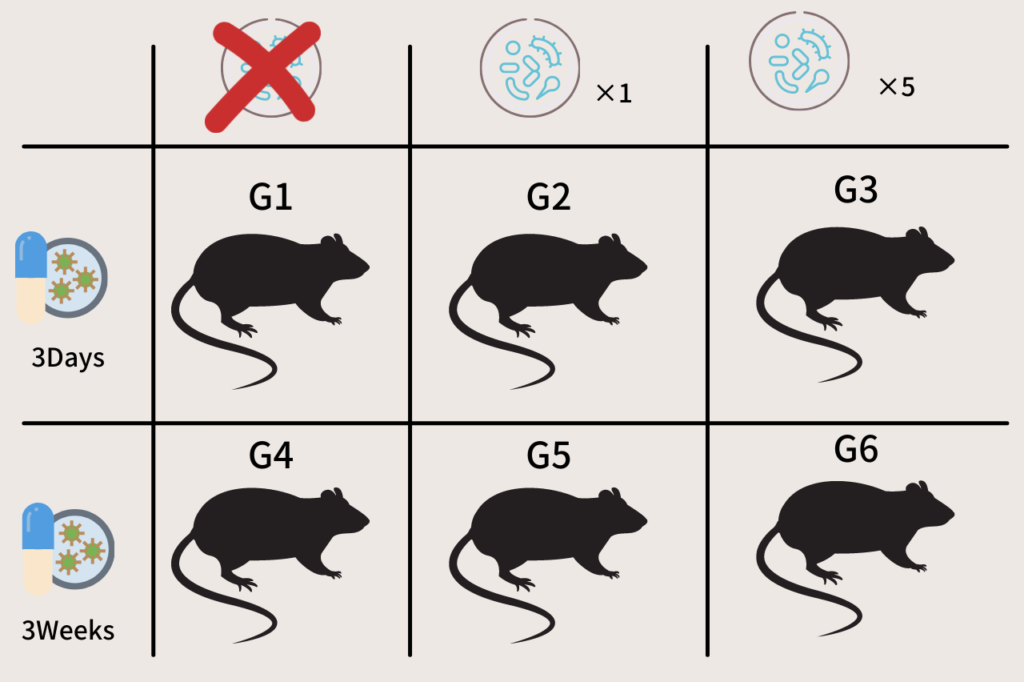
手作り画像なんで、微妙にずれてるのは大目に見てね。
G1:3日間抗生剤投与、FMTなし
G2:3日間抗生剤投与、FMT1回
G3:3日間抗生剤投与、FMT5回
G4:3週間抗生剤投与、FMTなし
G5:3週間抗生剤投与、FMT1回
G6:3週間抗生剤投与、FMT5回
30匹のマウスたちに対して、下記のそれぞれのポイントで、腸内フローラ解析や、短鎖脂肪酸などの代謝産物測定が行われました。
T0:最初
T1:抗生剤投与後、FMT前
T2:抗生剤投与後、FMT直後
T3:FMT1週間後
T4:FMT2週間後
T5:FMT3週間後
FMTはすべてT1とT2の間に行われています。
結果
実験結果は「多様性の回復」「ヒトの菌が定着したか」「増えた菌の種類」の3つの観点から書かれています。
多様性の回復度合い

抗生剤投与後のT1-T2の期間は、どのマウスも腸内細菌の多様性が低下しましたが、T2-T5の期間でどれも回復に転じました。
G1-G3のグループのマウスたちは、概ねもとの多様性を回復し、むしろ移植されたヒトのドナーよりも高い多様性を回復しました。
一方、G4-G6のグループのマウスたちは、T5に至っても低い多様性にとどまりました。
詳しくはFigure 2 のA の図をご覧ください。
G1とG2>G3>G6>G4とG5
という順番になっており、G4-G6 のマウスにほとんど変化が見られませんでした。
G1-G3 のマウスには3 日間抗生剤を投与しています。一方G4-G6 のマウスにはその7 倍の3 週間抗生剤を投与しています。抗生剤投与の影響で多様性が失われたことが分かります。
ヒトの菌が生着した度合い
Amplicon sequence variant (ASV) is a term used to refer to single DNA sequences recovered from a high-throughput marker gene analysis. These amplicon reads are created following the removal of erroneous sequences generated during PCR and sequencing. This allows ASVs to distinguish sequence variation by a single nucleotide change.
Amplicon sequence variant – Wikipedia
(ハイスループットマーカー遺伝子分析から回収された単一のDNA配列を指すために使用される用語です。これらのアンプリコンリードは、PCRおよびシーケンス中に生成された誤ったシーケンスを削除した後に作成されます。これにより、ASVは単一のヌクレオチド変化によって配列変異を区別することができます。)
論文を読んでみると、なんとなく意味がわかります。
ASVとは、遺伝子レベルで「これ人間の菌」「これマウスの菌」ということが判断できるようです。
実験では、移植した菌液に含まれているASVをヒトのASV、移植前のマウスにだけ見られたASVをマウスのASVとしています。
結果、G3とG6のマウス間の比較では、両方ともT3期でヒトASVが多く、G6のマウスのほうがヒトのASVを多く有していました。(73対28)
T2-T5期におけるマウス自身のASVの再発現に関しては、G2グループで75%、G3グループで50%だったのに対し、G6グループでは25%にとどまりました。
ここで先の情報を再掲しますと、
G1:3日抗生剤投与、FMTなし
G2:3日抗生剤投与、FMT1回
G3:3日抗生剤投与、FMT5回
G4:3週間抗生剤投与、FMTなし
G5:3週間抗生剤投与、FMT1回
G6:3週間抗生剤投与、FMT5回
T0:最初
T1:抗生剤投与後、FMT前
T2:抗生剤投与後、FMT直後
T3:FMT1週間後
T4:FMT2週間後
T5:FMT3週間後
FMTはすべてT1とT2の間に行われています。
増えた菌の種類
Firmicutes 門(特にLachnospiraceae 科)という菌は、ヒトのドナーに多くみ られる菌です。 Firmicutes 門というのは、細菌の門のひとつです。
ところで、門というのは、分類階級の最上位にある階級を示しています。 細菌(バクテリアドメイン)の分類階級は上位から、門(phylum)、綱(class)、目 (family)、科(order)、属(genus)、種(species)に分けられているため、例 えば新しい門に属するということは系統学的にみて、極めて新規性の高い細菌であるとい うことを示しています。https://qr.paps.jp/zFNOb (出典元:国立研究開発法人産 業技術総合研究所 新しい門 )
ヒト由来の Bacteroides 門が、抗生剤により消え去ったと思われたマウス自身の Bacteroides 門を刺激し、回復させたのではないか?と推察されます。
定着する、とはそもそもどういうことか

この論文の結論として、FMTを何度も行うことと、事前の抗生剤投与を実施することは、菌を生着させるうえで有用な選択肢となりうるとされています。
さて、ここで「定着」の意味をちょっと考えてみたいと思います。
この実験で示されているのは「移植したヒトのドナーの菌が、移植後にどれだけ残っているか」という評価軸による定着です。
乱れた腸内細菌のバランスを、ドナーの腸内細菌に塗り替えることで、腸内 フローラバランスは回復し、健康を取り戻せるはずだという仮説がそこにはうかがえます。
この論文の結論は、言い換えると
「もともとレシピエント(ここではマウス)が持っている腸内フローラを一旦消し去り、ドナーの腸内フローラバランスにごっそり入れ替えたいなら、この方法が有効」と。
私たちの移植の考え方
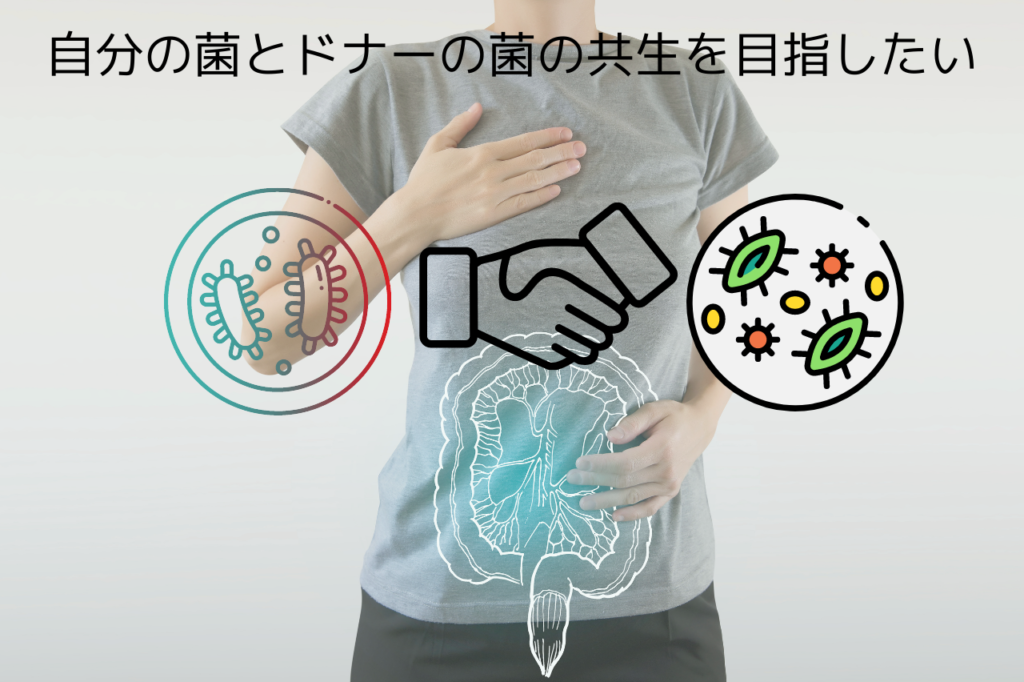

我々の方法でFMTを行っていただくと結論は変わってくると思います。薬剤による菌の抑制は一時的には効果があっても、長期的には菌交代現象に代表されるようにマイナス面の方が大きくなります。我々のFMTは「種の区別」よりも「融合・共生」に効果を期待しているので、「定着面積を広げるFMT」という意味ではコンセプトから外れますね。
一部の大学は当該論文のような考え方をして他の大学や国に働き掛けているので、難しいかもしれませんが、我々も世界に認められるような学術的な集団になることが急がれると思っています。
「定着面積を広げるFMT」という新しいワードが出てきましたね。
ただでさえ長いブログになってるのに、どうしよ。
簡潔に説明しますと、弊所の菌液はNanoGAS™というナノバブル水を使っているんです。
患者さんの腸は菌の住処が減ってしまっていることが多いんですが、
NanoGAS™を溶媒に使うことによって、抗生剤のように「他の菌を排除」するのではなく、物理的に腸の中に菌の住処を増やそうよ、というコンセプトです。
さらっと書いてしまいましたが、自信持ってやっています。
FMTにもいろんな方法がありますが、いつか「標準法」が確立されていくでしょう。
短期的にも、長期的にも、患者さんがよくなって喜んでもらえるような方法が、ちゃんと正当に評価されていきますように。
その他の ブログ に関する記事
Articles about other ブログ

2021年10月26日
FMTのゴールは? 移植回数と事前抗生剤投与が菌の生着に与える影響
移植回数と事前抗生剤投与が菌の生着に与える影響 原文Microorganisms | Free Full-Text | Engraftment of Bacteria after Fecal Microbiota Tra […]

2021年08月03日
腸内細菌が粘膜の内側まで入るタイミング
腸内細菌は外粘液層にしかいないという常識 腸の中は、菌や食べ物、水分などの通り道としてホース状の空洞になっています。ホースの内側がいきなり大腸の細胞になっているわけではなく、粘液と粘膜層が外と内を隔てています。 粘液層の […]
2021年05月31日
パーキンソン病や耐性菌にFMTが有効
FMTがパーキンソン病の症状を緩和 (原文)Evaluation of fecal microbiota transplantation in Parkinson’s disease patients wit […]




